La combinación de estradiol bioidéntico y progesterona micronizada ha mostrado en la literatura científica nula asociación con eventos trombóticos ni aumento de cáncer de mama.
Las advertencias sobre TRH se remontan al año 2002 con el estudio WHI (Women’s Health Initiative), que vinculó la terapia combinada CEE+MPA (Estrógenos Conjugados Equinos + Medroxiprogesterona) con un aumento en el riesgo de cáncer de mama y eventos cardiovasculares.
Dr. Alfonso Galán – Equipo Médico Neolife
Mujeres con síntomas debilitantes fueron alejadas de un tratamiento eficaz por miedos infundados, perdiendo calidad de vida y protección ósea y vascular.
En julio de 2025, la FDA (Administración de Alimentos y Medicamentos de Estados Unidos) convocó a un panel de expertos para reevaluar la evidencia sobre la Terapia de Reemplazo Hormonal (TRH) en mujeres menopáusicas. Este hecho marca un punto de inflexión en la narrativa institucional que, durante décadas, ha estado dominada por el miedo, los “black box warnings” y una percepción errónea de riesgo.
Desde Neolife celebramos este paso como un acto de justicia científica y sanitaria, pero también como un recordatorio de cuánto daño ha causado la desinformación sobre la TRH. En este artículo analizamos en profundidad las conclusiones del panel, los estudios clave discutidos y, sobre todo, que las formulaciones que usamos en Neolife (estradiol bioidéntico y progesterona micronizada) no han mostrado ningún aumento de riesgo cardiovascular ni de cáncer.

¿Qué se dijo en el panel de la FDA?
- Eliminación de las advertencias más severas (“black box warnings”) para ciertas formas de TRH.
- Reconocimiento de beneficios antes minimizados: protección cardiovascular, mejora de la salud ósea, reducción de sofocos y mejora del estado de ánimo, especialmente en mujeres menores de 60 años o en los primeros 10 años postmenopausia.
- Ausencia de distinción entre tipos de formulaciones: una crítica importante fue no diferenciar entre tratamientos con estrógenos conjugados equinos (CEE) y medroxiprogesterona (MPA), frente a opciones bioidénticas.
El legado del WHI y sus consecuencias
Las advertencias sobre TRH se remontan al año 2002 con el estudio WHI (Women’s Health Initiative), que vinculó la terapia combinada CEE+MPA con un aumento en el riesgo de cáncer de mama y eventos cardiovasculares. Pero en los años posteriores se ha comprendido que:
- El riesgo observado no aplica a todas las formulaciones ni a todas las mujeres.
- El inicio tardío del tratamiento (edad media en WHI: 63 años) distorsionó los resultados.
- No se usaron estrógenos bioidénticos ni progesterona micronizada.
Como resultado, millones de mujeres renunciaron a una terapia beneficiosa, basándose en miedos que hoy consideramos infundados para muchas pacientes.
Evidencia actual: ¿qué dice la ciencia sobre TRH bioidéntica?
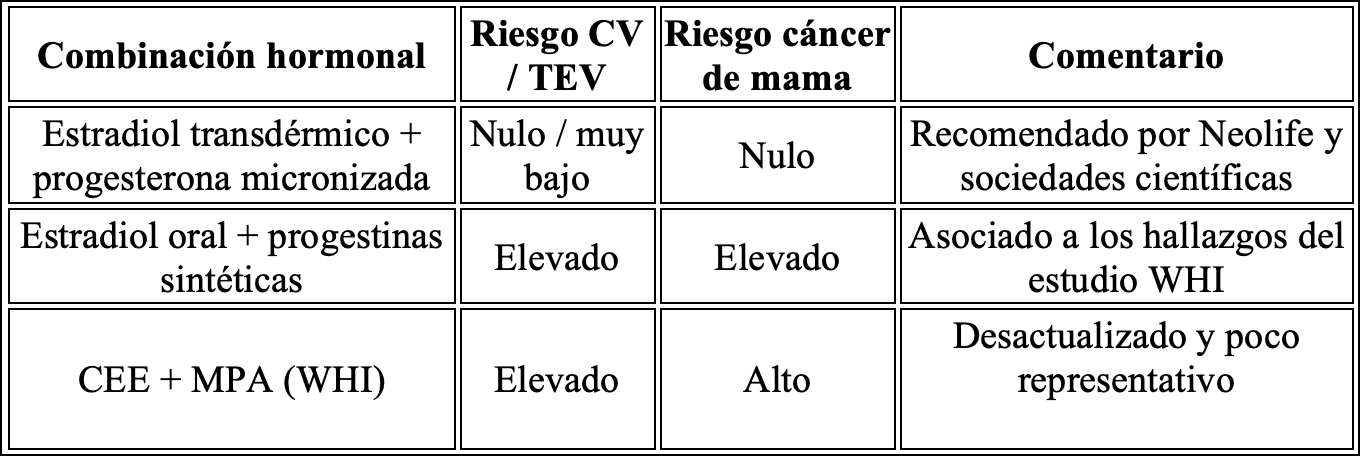
Estudios como E3N (Francia) han demostrado que el estradiol bioidéntico combinado con progesterona micronizada oral NO incrementa el riesgo de cáncer de mama (RR: 0,9).
Un metaanálisis (Scarabin, 2018) confirma que la combinación más segura es estradiol transdérmico + progesterona micronizada, sin aumento significativo de riesgo tromboembólico.
Diferencias entre formulaciones
La posición de Neolife: evidencia, personalización y seguridad
En Neolife utilizamos TRH de forma personalizada, con:
- Estradiol bioidéntico
- Progesterona micronizada
- Monitorización analítica y clínica periódica
Esta combinación ha mostrado en la literatura científica nula asociación con eventos trombóticos ni aumento de cáncer de mama en uso a corto o medio plazo.
¿Y ahora qué?
Si la FDA está dispuesta a reconsiderar las advertencias severas en base a la evidencia actual, el siguiente paso lógico es retractarse y disculparse por el daño ocasionado durante dos décadas. Mujeres con síntomas debilitantes fueron alejadas de un tratamiento eficaz por miedos infundados, perdiendo calidad de vida y protección ósea y vascular.
La medicina debe tener el valor de rectificar. Hoy sabemos que la TRH bien indicada, con formulaciones bioidénticas y personalizadas, es una herramienta poderosa, eficaz y segura para muchas mujeres.
Conclusión
El panel de la FDA marca un cambio de rumbo, pero aún hay camino por recorrer, muchos médicos y muchos pacientes por educar. En Neolife llevamos años aplicando un enfoque basado en evidencia, alejados del dogma y con la seguridad como prioridad. Es el momento de reescribir la narrativa de la TRH, con ciencia, prudencia y respeto por la salud femenina.
BIBLIOGRAFÍA
(1) Scarabin, P. Y. (2018). Progestogens and venous thromboembolism in menopausal women: an updated oral versus transdermal estrogen meta-analysis. Climacteric, 21(4), 341–345.
(2) Fournier, A. et al. (2008). Use of different postmenopausal hormone therapies and risk of histology- and hormone receptor-defined invasive breast cancer. Journal of Clinical Oncology, 26(8), 1260–1268.
(E3N cohort, Francia)
(3) Manson, J. E. et al. (2013). Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA, 310(13), 1353–1368.
(4) The NAMS 2022 Hormone Therapy Position Statement Advisory Panel. (2022). The 2022 Hormone Therapy Position Statement of The North American Menopause Society. Menopause, 29(7), 767–794.
(5) FDA Expert Panel on Menopause and Hormone Replacement Therapy (2025). U.S. Food & Drug Administration Public Meeting Archive: July 17, 2025.



