Un metaanálisis concluye que el uso de TRH no lleva a un aumento de riesgo de recurrencia de cáncer en supervivientes de cáncer de mama y que además, lleva a un descenso significativo de la mortalidad por todas las causas (3% vs 11,4%).
El uso de quimioterapia tiene un efecto citotóxico en los ovarios que resulta en fallo ovárico prematuro entre el 20% y 80% de las mujeres resultando en deficiencia de hormonas sexuales. Asimismo, el uso de fármacos antiestrogénicos e inhibidores de la aromatasa empeora el déficit hormonal y lleva a síntomas que hacen que alrededor de un 50% de las mujeres abandonen el tratamiento con tamoxifeno.
Dr. Alfonso Galán González – Equipo Médico Neolife
Si una cosa debemos hacer los médicos es aprender, desaprender y reaprender. Estamos obligados a estar pendientes de las nuevas evidencias que la literatura científica demuestra incluso si esto va en contra de lo que nos han enseñado.
Una vez visto en la parte I de esta newsletter la relación de la TRH con el cáncer de mama y la seguridad del uso de la Terapia de Teemplazo Hormonal con hormona bioidéntica, vamos a preguntarnos ¿qué dice la literatura sobre su uso en pacientes supervivientes de un cáncer de mama?.
Encontrar literatura en este sentido es complicado por diferentes factores. Uno es, evidentemente, que con el miedo a “producir cáncer” con la TRH, que ya sabemos es injustificado como se ha referido en la parte I de esta newsletter, no son muchos los estudios disponibles; gran parte de ellos se han hecho sobre mujeres que por la quimioterapia o el tratamiento con inhibidores del receptor estrogénico, como tamoxifeno, presentan síntomas de déficit estrogénico intolerables como sofocos sobretodo.
El otro factor es, como también comentamos en la entrada previa, la enorme confusión que los estudios crean al agrupar bajo el término estrógenos los sintéticos como los equinos (CEE) y los bioidénticos (estradiol) y bajo el término progestágenos todos aquellos fármacos con efectos progestagénicos y que actúan sobre los receptores de progesterona (PR) sin distinguir entre progestinas (derivados sintéticos) y progesterona bioidéntica.
Esta distinción, que raramente hacen, es vital como hemos explicado en múltiples artículos, ya que los efectos de las progestinas y estrógenos sintéticos son radicalmente diferentes a los de los compuestos que ocurren naturalmente en el cuerpo de la mujer, sobretodo en su relación con el desarrollo o, en este caso, recurrencia de cáncer.
Cáncer de mama
El cáncer de mama representa el 30% de los cánceres diagnosticados a mujeres en España. Su incidencia se estima en 1 de cada 8 mujeres (13%). El pico de incidencia es entre los 45 y 65 años. En el grupo de mujeres diagnosticadas más tarde (>50 años) es mucho más probable la presencia de un cáncer con receptores hormonales positivos.
No es el objetivo de este artículo ahondar en las causas y diferentes clasificaciones o tratamientos según estadios.
Para el objeto de este texto señalamos que el uso de quimioterapia tiene un efecto citotóxico en los ovarios que resulta en un fallo ovárico prematuro entre el 20% y el 80% de las mujeres resultando en deficiencia de hormonas sexuales. Así mismo, el uso de fármacos antiestrogénicos e inhibidores de la aromatasa empeora el déficit hormonal y lleva a síntomas que hacen que alrededor de un 50% de las mujeres abandonen el tratamiento con tamoxifeno.
Por tanto, si a los efectos del tratamiento le sumamos la edad a la que suele ocurrir la patología, encontramos que un gran número de mujeres presentará un déficit de hormonas sexuales, bien por menopausia establecida o bien por los tratamientos prescritos.
El deterioro de calidad de vida asociado a esto es muy importante, no solo son síntomas físicos como sofocos, síntomas urogenitales o psicológicos, también lleva a osteoporosis, enfermedad cardiovascular y deterioro cognitivo entre otras muchas cosas.
Entonces, ¿qué hacemos con estas mujeres? ¿les tenemos que negar la Terapia de Reemplazo Hormonal (TRH) que tanto beneficio les supondría por haber tenido un cáncer de mama?
Vamos a ver qué dice la literatura científica disponible y la ciencia básica.
Meurer et al. llevaron a cabo un metaanálisis concluyendo no sólo que el uso de TRH no lleva a un aumento de riesgo de recurrencia de cáncer en supervivientes de cáncer de mama sino que además lleva a un descenso significativo de la mortalidad por todas las causas (3% vs 11,4%).
Batur et al. demostraron resultados similares con un menor riesgo de muerte asociada a cáncer de mama en mujeres que usaban TRH con un 50% de reducción del riesgo de recurrencia.
Los ensayos clínicos randomizados aleatorizados (RCT) mostraban resultados dispares, con unos hablando de aumento de riesgo y otros de disminución del mismo. La causa de esta heterogeneidad es múltiple (diferentes edades, tipos de tumores, diferentes tiempos de seguimiento, etc.) pero sobre todo es la heterogeneidad de pautas de TRH usadas con la mayoría de ellos usando estrógenos de síntesis y derivados sintéticos de la progesterona, progestinas como la medroxiprogesterona acetato-MPA, que ya sabemos desde la publicación del Estudio WHI, ampliamente mencionado en estos textos, que se asocia a cáncer de mama y enfermedad tromboembólica.
Si vamos un poco más allá y miramos las intervenciones realizadas en estos RCTs y seleccionamos aquellos estudios que han usado hormonas bioidénticas obtenemos resultados muy reveladores.
El estudio realizado por Natrajan et al. usando estradiol y testosterona bioidénticas en pellets y usualmente con megestrol como progestágeno, demostró que no había un aumento de recurrencias o de mortalidad asociada a cáncer de mama. El uso de estradiol bioidéntico y de una progestina como el megestrol que la literatura nos dice que no tiene la asociación con cáncer que tienen otras como la mencionada MPA, levonorgestrel o NETA (noretindrona acetato), podría ser lo que explique estos buenos resultados.
El estudio realizado por Fahlen et al. y publicado en el European Journal of Cancer, propuso continuar el Stockholm trial que estudiaba esto en mujeres recibiendo estradiol y MPA y que fue parado bruscamente a la vista de los resultados del estudio HABITS. El estudio HABITS fue parado al observar un aumento de recurrencias de cáncer de mama en mujeres usando TRH consistente en estrógenos con NETA o estrógenos solos sin oposición por progestágenos. Pues bien, en el momento de ser parado, el Stockholm trial no había mostrado un aumento de recurrencias tras 4 años de seguimiento. Fahlen continuó el estudio hasta los 10 años bajando la dosis de la progestina usada, MPA y manteniendo estradiol oral, ¿el resultado? no se encontraron diferencias significativas entre ambos grupos en mortalidad o recurrencia.
Por último, menciono el estudio realizado por Le Ray et al. en el que aplicaron estradiol transdérmico local en mujeres con sintomatología de sequedad vaginal asociada al tratamiento, no observó un aumento del riesgo de recurrencias en ninguno de los grupos (tratadas con tamoxifeno, inhibidores de aromatasa o sólo estradiol local).
La ciencia básica que estudia cómo se comportan los receptores hormonales en las células de mama normales y en células cancerígenas nos da algunas pistas importantes con respecto a lo que nos indican todos estos estudios.
Años de investigación han revelado una compleja y, en ocasiones, funcionalmente contradictoria conexión entre la señalización asociada a receptores estrogénicos (ER) y receptores de progesterona (PR) en el cáncer de mama. Parece que hay una clara diferencia en la respuesta de los tejidos a la presencia de estradiol y progesterona entre las células normales de mama y las malignas. Mientras que en tejido sano hacen proliferar las células ER- y PR- productoras de leche; en las células malignas (mucho más ricas en células ER+ y PR+ ) éstas serán las células que proliferen en presencia de estrógeno teniendo la progesterona un efecto antiproliferativo.
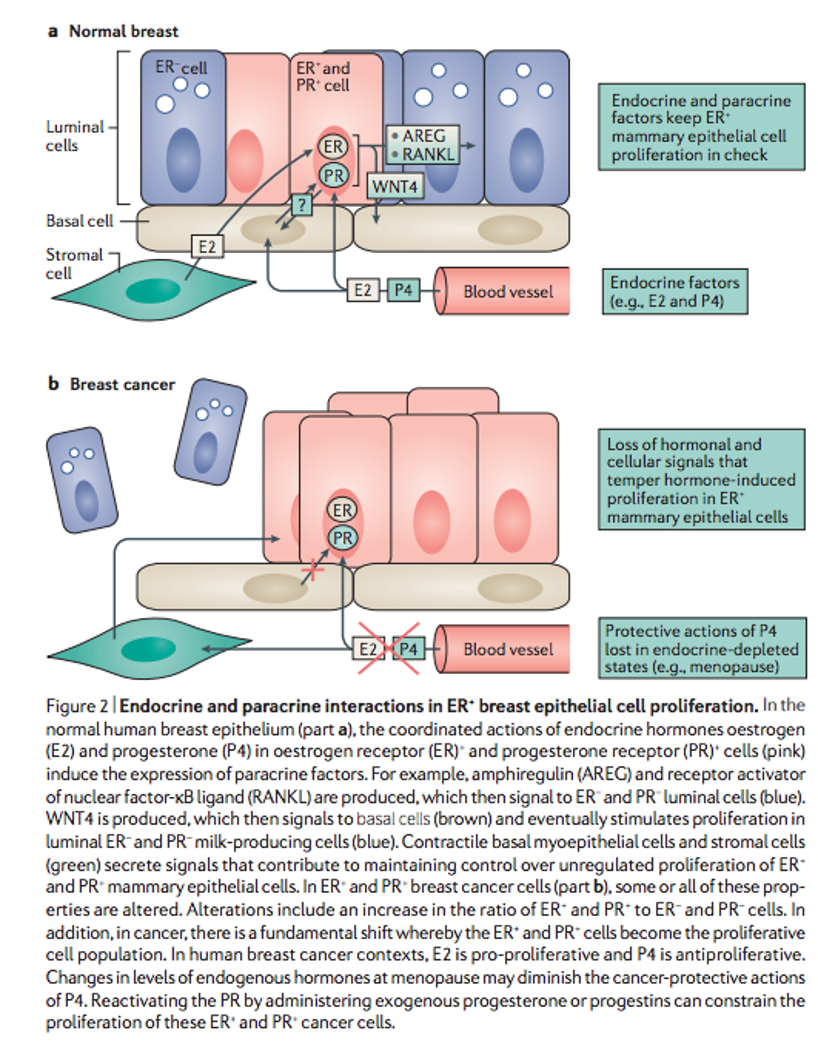
Una observación recurrente es que, en situaciones de cáncer de mama con ER+, los agonistas de PR tienen beneficio clínico, una conclusión apoyada en la abundancia de datos clínicos que muestran la eficacia de tratamiento con progesterona en esta enfermedad. Explotando esta interacción entre la activación de ambos receptores encontramos una oportunidad única para el tratamiento de cáncer de mama con receptores hormonales positivos. Su uso con agentes que se liguen al ER parece más eficaz.
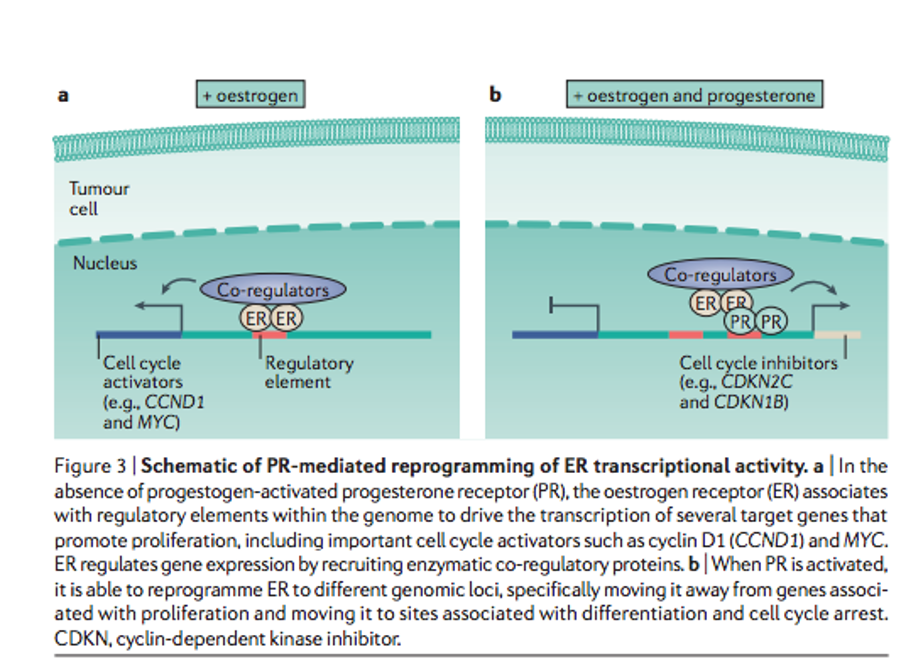
Cuando están activados sólo los receptores estrogénicos (ER), se produce un estímulo para la transcripción de factores que llevan a un aumento de la proliferación celular. Mientras que si se activan a la vez los de progesterona se reprograman los genes sobre los que actúan los ER llevándole a aumentar la expresión de genes que llevan a parar el ciclo celular y el crecimiento.
La observación de que las mujeres postmenopáusicas con tumores PR+ tienen mejor pronóstico, mientras que las postmenopáusicas no, se explica por la presencia de un ovario aún productor de progesterona en las primeras y no en las segundas, que han de recibir un progestágeno exógeno para tener un beneficio clínico.
Por tanto y para concluir, la evidencia científica disponible avalaría el uso de TRH con hormona bioidéntica en supervivientes de cáncer de mama siempre que esa pauta lleve progesterona, por supuesto. ¿Y en tumores que expresaron receptores hormonales (ER + PR+)? la respuesta podría la misma, de hecho los estudios que he mencionado -y alguno que no he mencionado- que han mostrado beneficio en recurrencia en sus resultados informaron de haber incluido tumores con ER+. Parece más que claro, por lo expuesto, que la progesterona no es sólo segura sino que podría ser parte esencial del tratamiento sobre todo en aquellas mujeres con cánceres activos no respondedoras a tamoxifeno. ¿Puede el estradiol ser el ligado de los receptores estrogénicos que se precisa para que la progesterona ejerza su efecto anticancerígeno? ¿Es realmente sólo necesario “algo” que se una al ER que sea inicialmente antagonista como el tamoxifeno o agonista como el estradiol?. Ese sería un ensayo clínico que sería muy interesante y muy importante para las mujeres en tratamiento por cáncer de mama con receptores positivos ya que la diferencia en su calidad de vida recibiendo uno u otro compuesto puede ser muy diferente. Lo que sí está claro es que tenemos que replantearnos muy seriamente la idea algo simplista de que los ER se activan con estradiol y se inhiben con tamoxifeno. Lo que pasa una vez que “algo” se une al receptor es mucho más complejo de lo que pensábamos y puede tener la respuesta para explicar las diferentes evoluciones post-cáncer.
BIBLIOGRAFÍA
(1) Mudhune GH, Armour M, McBride KA. Safety of menopausal hormone therapy in breast cancer survivors older than fifty at diagnosis: A systematic review and meta-analysis. Breast. 2019;47:43-55. doi:10.1016/j.breast.2019.06.002
(2) O’Meara ES, Rossing MA, Daling JR, Elmore JG, Barlow WE, Weiss NS. Hormone replacement therapy after a diagnosis of breast cancer in relation to recurrence and mortality. J Natl Cancer Inst. 2001;93(10):754-762. doi:10.1093/jnci/93.10.754
(3) Carroll JS, Hickey TE, Tarulli GA, Williams M, Tilley WD. Deciphering the divergent roles of progestogens in breast cancer. Nat Rev Cancer. 2017;17(1):54-64. doi:10.1038/nrc.2016.116
(4) MeurerLN,LenaS.Cancer recurrence and mortality in women using hormone replacement therapy: meta-analysis. J Fam Pract 2002;51:1056e62.
(5) Batur P, et al. Menopausal hormone therapy (HT) in patients with breast cancer. Maturitas 2006;53(2):123e32.
(6) Natrajan PK, Soumakis K, Gambrell JrJr. Estrogen replacement therapy in women with previous breast cancer. Am J Obstet Gynecol 1999;181(2):288e95.
(7) Le Ray I, et al. Local estrogen therapy and risk of breast cancer recurrence among hormone-treated patients: a nested case control study. Breast Canc Res Treat 2012;135(2):603e9.
(8) Fahlen M, et al. Hormone replacement therapy after breast cancer: 10 year follow up of the Stockholm randomised trial. Eur J Cancer 2013;49(1):52e9.