Tenemos nuevas evidencias de cómo la inflamación participa fundamentalmente en la aterogénesis y en la fisiopatología de los eventos isquémicos.
Más allá de la dislipemia, un conjunto convincente de datos experimentales y clínicos ahora indica que atacar directamente a la inflamación puede reducir los eventos cardiovasculares incluso en personas que ya han sido tratadas con el espectro completo de tratamientos efectivos conocidos.
Dr. Alfonso Galán González – Equipo Médico Neolife
Inmunidad
Tras ajustar para todos los factores de riesgo tradicionales, La Hematopoyesis monoclonal de potencial indeterminado (CHIP) confiere un riesgo de infarto de miocardio y accidente cerebrovascular igual o mayor que los contribuyentes previamente reconocidos al riesgo cardiovascular, salvo la edad.
Más allá de la dislipemia, un conjunto convincente de datos experimentales y clínicos ahora indica que la inflamación participa fundamentalmente en la aterogénesis y en la fisiopatología de los eventos isquémicos1. Las respuestas inflamatorias proporcionan una serie de vías que vinculan los lípidos y otros factores de riesgo tradicionales con la aterosclerosis. Por ejemplo, las concentraciones de lipoproteína remanente muestran vínculos con los niveles de proteína C reactiva, un biomarcador de inflamación. Una gran cantidad de evidencia implica la inflamación en la hipertensión2.
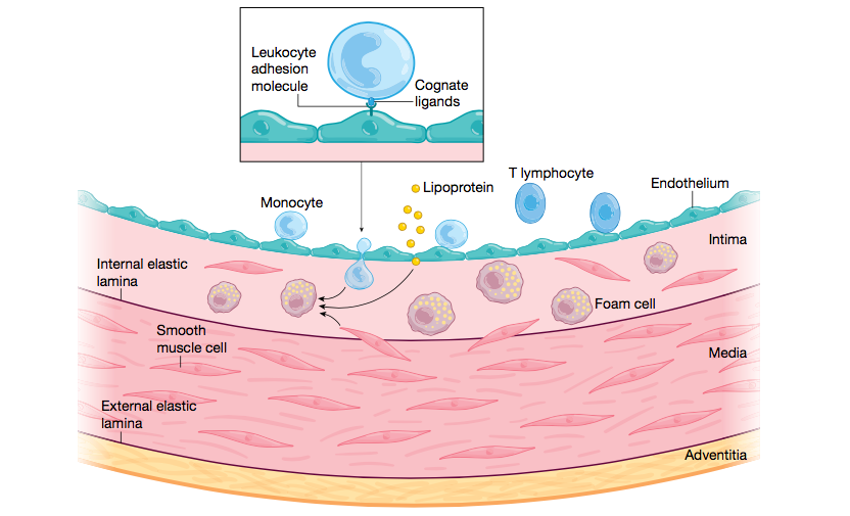
Las investigaciones experimentales han señalado la participación de la inmunidad innata y adaptativa en la aterosclerosis. Estudios de biomarcadores humanos han demostrado que los indicadores de inflamación predicen el riesgo de enfermedad cardiovascular en una amplia franja de personas con o sin enfermedad cardiovascular manifiesta, e independientemente de todos los factores de riesgo tradicionales3. El reactante de fase aguda conocido como Proteína C reactiva (PCR), que puede medirse con un ensayo altamente sensible (PCR Ultrasensible), es un indicador validado y clínicamente útil del estado inmunológico innato general de un individuo en relación con el riesgo aterosclerótico.
Además de la inmunidad innata (que depende en gran medida de las citocinas y los macrófagos), el brazo adaptativo de la respuesta inmune también opera durante la aterogénesis. Los linfocitos T tienden a agravarla, pero dentro de ellos, los T-helper 2 y las células T reguladoras pueden silenciar este proceso.
Inflamación
La aplicabilidad a los seres humanos de la evidencia experimental que implicaba inflamación en la aterosclerosis ha generado una controversia considerable4. Sin embargo, ensayos clínicos recientes han demostrado que atacar directamente a la inflamación puede reducir los eventos cardiovasculares incluso en personas que ya han sido tratadas con el espectro completo de tratamientos efectivos conocidos.
El Canakinumab Anti-inflammatory Thrombosis Outcomes Study’ (CANTOS) asignó al azar este anticuerpo que neutraliza la citocina proinflamatoria IL-1β a pacientes con enfermedad arterial coronaria estable un mes, al menos, después de haber tenido un infarto. Estos pacientes tenían una PCR Ultrasensible superior a 2 y un LDL de 81 mg/dl de media. La terapia antiinflamatoria redujo en un 15% la posibilidad de un nuevo infarto, Ictus o muerte de causa cardíaca. Los individuos que respondieron a la neutralización de IL-1β logrando una reducción mayor que la media de PCR lograron una reducción mayor, del 26%. Eso sí, dado que la IL-1β participa en las defensas del huésped, no fue sorprendente que CANTOS mostrara un aumento pequeño, pero estadísticamente significativo, de infecciones (incluidas algunas fatales) en los pacientes asignados al azar a canakinumab. Sin embargo, una reducción muy significativa de los casos de cáncer de pulmón incidentes y mortales contrarrestó este riesgo de infección5.
La colchicina la hemos usado como antiinflamatorio desde hace muchos años, de hecho, es el estándar de tratamiento para pericarditis. Dos estudios recientes a gran escala han demostrado su eficacia para reducir la recurrencia de eventos cardiovasculares recurrentes tras un síndrome coronario agudo. El ‘Colchicine Cardiovascular Outcomes Trial’ (COLCOT) mostró una reducción del 23% en necesidad de revascularización en pacientes tratados en la fase inicial después de desarrollar un síndrome coronario agudo (4-30 días)6. Eso si, la incidencia de neumonía aumentó a más del doble en el grupo que fue tratado con colchicina.
El estudio ‘Low Dose Colchicine 2’ (LoDoCo2) administró colchicina (5 mg/d) a personas con enfermedad arterial coronaria estable y notificó una reducción de los eventos recurrentes similar a la observada en el COLCOT7.
Estos resultados, por supuesto, han reforzado la aplicabilidad clínica de décadas de investigación fundamental sobre las vías inflamatorias en la patogenia de la aterosclerosis. El aumento de infecciones observado con canakinumab y colchicina nos indica que debemos refinar la terapia antiinflamatoria para la ateroesclerosis cara a interferir menos en las defensas del individuo.
CHIP
Recientemente ha surgido un aspecto adicional de riesgo, que también está asociado con la inflamación.
Con la edad, acumulamos mutaciones somáticas en células madre hematopoyéticas de la médula ósea en genes que impulsan el desarrollo de leucemia aguda8. Los investigadores que andaban buscando el origen de la leucemia encontraron que los individuos que aparentemente se encuentran bien y no tienen neoplasias hematológicas malignas pueden generar clones de leucocitos que circulan en la sangre periférica y que portan mutaciones en un puñado de los genes causantes conocidos de leucemia.
La prevalencia de esta afección en personas de 70 años supera el 10%, y esta carga aumenta con el envejecimiento. A medida que la población envejece, aumentará la cantidad de individuos que portan estos clones. Como era de esperar, quienes padecen esta afección, conocida como hematopoyesis clonal de potencial indeterminado (CHIP), tienen un riesgo de desarrollar leucemia aguda más de diez veces mayor que el de las personas no afectadas. Sin embargo, el aumento de la mortalidad total en personas con CHIP supera con creces el atribuible a la transformación en leucemia aguda.
La enfermedad cardiovascular explica esta brecha en la mortalidad9. Tras ajustar para todos los factores de riesgo tradicionales, CHIP confiere un riesgo de
infarto de miocardio y accidente cerebrovascular igual o mayor que los contribuyentes previamente reconocidos al riesgo cardiovascular, salvo la edad.
Se la denomina de “potencial indeterminado” para reflejar la falta de síntomas o hallazgos de laboratorio consistentes en los portadores de estos clones mutantes de leucocitos periféricos y nuestra incapacidad actual para predecir qué individuos con CHIP desarrollarán leucemia o enfermedad cardiovascular.
De hecho, muchos portadores de CHIP (la mayoría) nunca sabrán que lo tienen.
La conexión entre el CHIP e inflamación surge de un trabajo experimental que demostró que los ratones diseñados para simular el CHIP mostraban ateroesclerosis acelerada y una mayor actividad de la vía proinflamatoria del inflamasoma- IL1β- IL610.
Las concentraciones del marcador de inflamación PCR Ultrasensible, antes mencionado, desgraciadamente no aumentan de manera constante en individuos con CHIP. Esta observación indica la existencia de aspectos de la inflamación que marcan un aumento del riesgo cardiovascular pero que no son capturados por las mediciones de PCR.
BIBLIOGRAFÍA
(1) Libby, P. & Hansson, G. K. From focal lipid storage to systemic inflammation: JACC review topic of the week. J. Am. Coll. Cardiol. 74, 1594–1607 (2019).
(2) Xiao, L. & Harrison, D. G. Inflammation in hypertension. Can. J. Cardiol. 36, 635–647 (2020).
(3) Ridker, P. M., Koenig, W., Kastelein, J. J., Mach, F. & Lüscher, T. F. Has the time finally come to measure hsCRP universally in primary and secondary cardiovascular prevention? Eur. Heart J. 39, 4109–4111 (2018).
(4) Hansson, G. K. Inflammation and atherosclerosis: the end of a controversy. Circulation 136, 1875–1877 (2017).
(5) Ridker, P. M. et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N. Engl. J. Med. 377, 1119–1131 (2017).
(6) Tardif, J. C. et al. Efficacy and safety of low-dose colchicine after myocardial infarction. N. Engl. J. Med. 381, 2497–2505 (2019).
(7) Nidorf, S. M. et al. Colchicine in patients with chronic coronary disease. N. Engl. J. Med. 383, 1838–1847 (2020).
(8) Jaiswal, S. et al. Age-related clonal hematopoiesis associated with adverse outcomes. N. Engl. J. Med. 371, 2488–2498 (2014).
(9) Jaiswal, S. et al. Clonal hematopoiesis and risk of atherosclerotic cardiovascular disease. N. Engl. J. Med. 377, 111–121 (2017).
(10) Libby, P. et al. Clonal hematopoiesis: crossroads of aging, cardiovascular disease, and cancer: JACC review topic of the week. J. Am. Coll. Cardiol. 74, 567–577 (2019).