La senescencia celular es uno de los 9 ‘’Hallmarlks of Aging’’. Algunas, pero no todas, las células senescentes, pueden adquirir lo que llamamos un fenotipo secretor asociado a senescencia (SASP).
La senescencia celular está relacionada de una manera u otra con la mayoría de las enfermedades y síndromes asociados al envejecimiento. Tenemos la posibilidad de actuar sobre ella influyendo el proceso de envejecimiento, la aparición de enfermedades y síndromes asociados a la edad.
Dr. Alfonso Galán González – Equipo Médico Neolife
Introducción
Las células senescentes son células que no se mueren, pero dejan de replicarse, se hacen “inmortales” resistiéndose a la apoptosis (muerte celular programada) y además con mucha frecuencia siguen siendo muy activas. De ahí el sobrenombre de “células Zombie”.
En esta entrada del blog vamos a hablar en profundidad de uno de esos 9 “Hallmarks of aging”, determinantes del envejecimiento o mecanismos moleculares del envejecimiento tan comentados en estos textos: la senescencia celular.
¿Por qué hablar de senescencia celular?
- La senescencia celular está relacionada de una manera u otra con los restantes 8 mecanismos.
- Está relacionada con la mayoría de las enfermedades y síndromes asociados al envejecimiento.
- Tenemos la posibilidad de actuar sobre ella influyendo en el proceso de envejecimiento, la aparición de enfermedades y síndromes asociados a la edad.
Creo que con esto queda más que justificada la pertinencia de este artículo y de otros que vendrán explicando las estrategias que tenemos para combatirla.
Envejecimiento
El envejecimiento está asociado con el riesgo de desarrollar múltiples enfermedades crónicas, los síndromes geriátricos, empeoramiento de la resiliencia física y mortalidad. Estos riesgos aumentan exponencialmente en el último cuarto de nuestra vida.
Entre las enfermedades para las que la edad es un factor de riesgo fundamental están:
Insuficiencia cardíaca, infarto de miocardio, demencia, ictus, cáncer, diabetes y enfermedades metabólicas, disfunción renal, enfermedad pulmonar crónica, osteoporosis, artritis, ceguera, etc…
Los síndromes geriátricos incluyen la fragilidad, sarcopenia, caídas, incontinencia y el deterioro cognitivo moderado, entre otros.
La peor resiliencia se manifiesta como recuperación más lenta tras infartos, ictus, lesiones, cirugías, mayor severidad de infecciones como la gripe o por coronavirus y peor generación de anticuerpos tras la vacunación. La causa de todas estas patologías y procesos que limitan la vida y capacidades del humano está en estos marcadores de envejecimiento.
Sabemos que la senescencia celular contribuye al desarrollo de inflamación, fibrosis, daño del ADN, desarrollo de agregados de proteínas, fallo de autofagia, lipotoxicidad, disfunción mitocondrial, depleción de NAD+, generación de especies reactivas del oxígeno (ROS) y disfunción de células madre, progenitoras e inmunes.
Senescencia celular
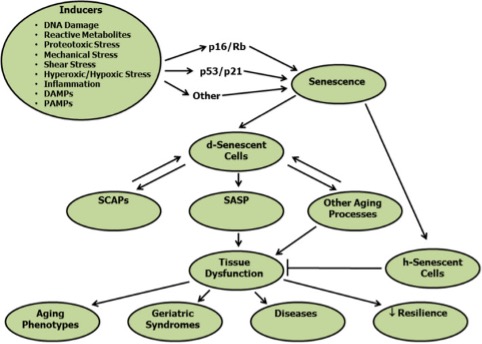
La senescencia celular fue descrita por primera vez en 1961 por Hayflick y Moorehead como un destino celular de cese irreversible de la replicación, viabilidad mantenida con resistencia a la apoptosis y, con mucha frecuencia, un aumento de la actividad metabólica. Entonces, para simplificarlo, son células que no se mueren, pero dejan de replicarse, se hacen “inmortales” resistiéndose a esa apoptosis (muerte celular programada) y además con mucha frecuencia siguen siendo muy activas.
Estas características son lo que ha llevado a que se las llame de forma coloquial “células Zombie”. Las causas que hacen que una célula pueda tomar este camino son muy variadas e incluyen señales asociadas a daño tisular o celular y desarrollo de cáncer. Incluyen:
- Daño al ADN
- Acortamiento telomérico
- Exposición a ADN extracelular
- Activación de oncogenes
- Estrés replicativo o inductores de la proliferación
- Agregados de proteínas y proteínas desestructuradas
- Fallo del reciclaje de proteínas por descenso de autofagia
- Presencia de AGE’s (productos avanzados de la glicosilación como la Hemoglobina glicada)
- Lípidos saturados o lípidos bioactivos como las bradikininas o prostaglandinas
- Metabolitos reactivos como las ROS
- Estrés mecánico como el asociado a la falta de cartílago en artrosis o el producido a en las placas de ateroma
- Citokinas inflamatorias como el TNF⍺
- DAMPS y PAMPS (damage associated molecular patterns y pathogen associated molecular patterns) esto es, contenidos intracelulares liberados al medio al destruirse células o endotoxinas bacterianas
Pues bien, sea por el estímulo que sea se activan una o más de las cascadas de factores de transcripción que promueven este estado de senescencia (p16 INK4a, p53, p21, Rb, etc..).
Por los datos que tenemos sobre cultivos celulares, se tarda de 10 días a 6 semanas en llegar a que las células alcancen un estado completo de senescencia. Esto tiene implicaciones importantes en el tratamiento como veremos al hablar de Senolíticos.
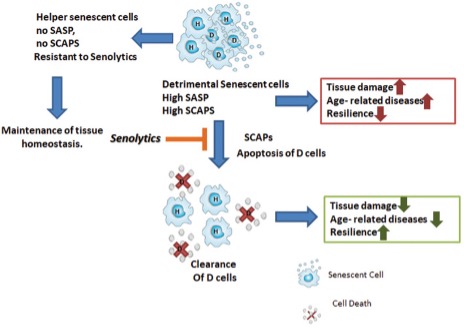
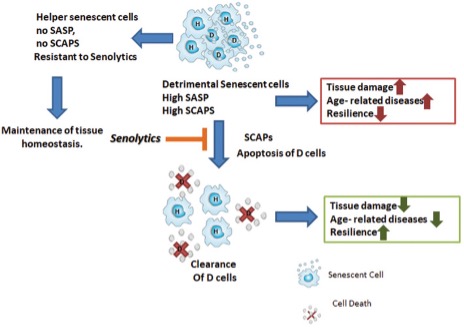
¿Qué hace tan malo el acúmulo de células senescentes y por qué queremos eliminarlas? Algunas, pero no todas, las células senescentes pueden adquirir lo que llamamos un fenotipo secretor asociado a senescencia (SASP) esto implica que estas células van a secretar:
- Citokinas proinflamatorias, proapoptóticas y que inducen resistencia a la insulina como TNF⍺, IL6, IL8 y otras.
- Quimiokinas que atraen, activan y anclan células inmunes.
- Metaloproteasas que causan destrucción tisular.
- Miembros de la familia del TGFß que llevan a fibrosis y disfunción de células madre y progenitoras.
- Activinas e inhibinas que también afectan a células madre y progenitoras.
- Otros factores como las Serpinas que llevan a trombosis y fibrosis.
- Factores de crecimiento que pueden llevar a diseminación tumoral.
- Lípidos bioactivos como Prostagalandinas, bradikininas y ceramidas que llevan a inflamación y disfunción tisular.
- MicroARN´s que también llevan a disfunción de células madre y progenitoras, inflamación y resistencia a la insulina.
- Exosomas que llevan estas señales citotóxicas e inductoras de senescencia a zonas vecinas o a distancia.
Las células senescentes que adquieren este fenotipo secretor son del 30 al 70% de las presentes y los mediadores que produzcan dependen del tipo de célula senescente y de la causa que originó su conversión.
Las células que no adquieren este fenotipo secretor las llamamos ‘’Helper’’ que parece que no liberan factores proinflamatorios o proapoptóticos, pero la verdadera utilidad de ellas y su interrelación con las secretoras no está dilucidada aún.
Este fenotipo secretor puede ser modulado por muchos factores como el ambiente hormonal, fármacos o patógenos.
Como todo en nuestro organismo, parece que la presencia de células senescentes tiene alguna función beneficiosa, de hecho, se han asociado a remodelamiento de tejidos durante el desarrollo y la cicatrización e incluso defensa frente al cáncer. Algunas investigaciones indican que si interferimos con estas cascadas mencionadas de conversión de las células en senescentes, podríamos promover el desarrollo de cáncer. Sin embargo, librarnos de las células senescentes ya formadas, muchas de las cuales llevan mutaciones oncogénicas o que llevan a formación de cáncer por su fenotipo secretor previene o retrasa el desarrollo de cáncer. Muchos estudios usando agentes senolíticos confirman este punto.
Aunque las células senescentes pueden aparecer en los tejidos humanos y de otros vertebrados en cualquier momento de su vida, se acumulan en la parte más tardía de sus vidas. Por ejemplo, las células senescentes cutáneas aumentan drásticamente de los 60 a 80 años en humanos sanos por lo demás.
Las células senescentes se acumulan en los sitios etiológicos de muchas enfermedades durante la vida. Por ejemplo en tejido adiposos en diabetes y obesidad, en hipocampo y corteza frontal en Alzheimer, en sustancia negra en Parkinson, Hueso y Médula ósea en osteoporosis, pulmones en fibrosis pulmonar, hígado en cirrosis, retina en DMAE (degeneración macular), placas en psoriasis, riñones en enfermedad renal, endotelio en preeclampsia, corazón y arterias en enfermedad cardiovascular….interesante, verdad? Desde luego, no es por casualidad.
Precisamente para demostrar que esto no es casualidad, hay experimentos en los que se inyectan células senescentes para determinar una causalidad, esto es, provocar enfermedad al introducir células senescentes en un tejido.
Al introducir células senescentes en las rodillas de ratones jóvenes causaron un estado de artrosis con hallazgos radiológicos y clínicos similares a los de la artrosis “natural”. Al inyectarles células no-senescentes esto no pasó. Otros estudios de este mismo tipo han causado fragilidad y aumento de mortalidad e insuficiencia renal a ratones sanos.
En el próximo artículo hablaremos de los fármacos y suplementos que están siendo investigados para matar selectivamente a estas células senescentes, senolíticos, y los fascinantes resultados que hemos obtenido hasta ahora.
BIBLIOGRAFÍA
(1) Kirkland JL, Tchkonia T. Senolytic drugs: from discovery to translation. J Intern Med. 2020;288(5):518-536. doi:10.1111/joim.13141
(2) Robbins PD, Jurk D, Khosla S, et al. Senolytic Drugs: Reducing Senescent Cell Viability to Extend Health Span. Annu Rev Pharmacol Toxicol. 2021;61:779-803. doi:10.1146/annurev-pharmtox-050120-105018
(3) Demaria M, Ohtani N, Youssef SA et al An essential role for senescent cells in optimal wound healing through secretion of PDGF‐AA. Dev Cell 2014; 31: 722–33
(4) Campisi J. Aging, cellular senescence, and cancer. Ann Rev Physiol 2013; 75: 685–705
(5) Xu M, Pirtskhalava T, Farr JN et al Senolytics improve physical function and increase lifespan in old age. Nat Med 2018; 24: 1246–56.10.1038/s41591-018-0092-9
(6) Chinta SJ, Woods G, Demaria M et al Cellular senescence is induced by the environmental neurotoxin paraquat and contributes to neuropathology linked to parkinson’s disease. Cell Rep 2018; 22: 930–40.
(7) Sun S, Cai B, Li Y et al HMGB1 and Caveolin‐1 related to RPE cell senescence in age‐related macular degeneration. Aging 2019; 11: 4323–37.
(8) Xu M, Bradley EW, Weivoda MM et al Transplanted senescent cells induce an osteoarthritis‐like condition in mice. J Gerontol A Biol Sci Med Sci 2017; 72: 780–5.
(9) Kim SR, Jiang K, Ferguson CM et al Transplanted senescent renal scattered tubular‐like cells induce injury in the mouse kidney. Am J Physiol Renal Physiol 2020; 318: F1167–F76.